Η έγκριση αυτή περιλαμβάνει τη φαρμακοτεχνική μορφή δισκίων καθώς και πόσιμου εναιωρήματος, που είναι σχεδιασμένο για νεότερους παιδιατρικούς ασθενείς που μπορεί να μην είναι ικανοί να καταπιούν δισκία.
Η ITP είναι μια σπάνια αιματολογική διαταραχή που επηρεάζει σχεδόν πέντε ανά 100.000 παιδιά κάθε χρόνο και χαρακτηρίζεται από χαμηλό αριθμό αιμοπεταλίων και χαρακτηρίζεται από το γεγονός ότι το αίμα δεν πήζει όπως θα έπρεπε λόγω χαμηλού αριθμού αιμοπεταλίων.
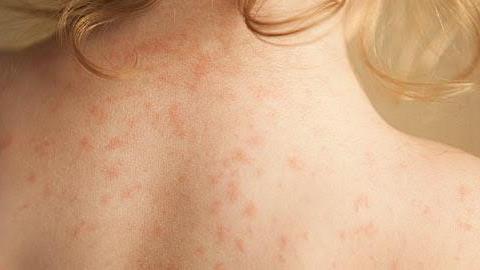
Οι ασθενείς που πάσχουν από ITP συχνά έχουν μωβ μελανιές ή πολύ μικρές κόκκινες ή μωβ κηλίδες στο δέρμα. Συχνά μπορεί να πάσχουν από ρινορραγίες, αιμορραγίες στα ούλα κατά τις οδοντιατρικές εργασίες, ή άλλες αιμορραγίες που είναι δύσκολο να σταματήσουν. Στις περισσότερες περιπτώσεις, η ΙΤΡ θεωρείται ότι προκαλείται από μια αυτοάνοση αντίδραση, όπου το ανοσοποιητικό σύστημα ενός ανθρώπου επιτίθεται και καταστρέφει τα αιμοπετάλιά του.
Η ελτρομβοπάγη ανήκει σε μια κατηγορία φαρμάκων που ονομάζονται αγωνιστές υποδοχέων της θρομβοποιητίνης. Χρησιμοποιείται για να βοηθήσει στην αύξηση του αριθμού των αιμοπεταλίων στο αίμα. Τα αιμοπετάλια είναι αιμοσφαίρια που βοηθάνε στη μείωση ή την πρόληψη αιμορραγίας.
Ο στόχος της θεραπείας στη χρόνια ITP στα παιδιά είναι να διατηρηθεί ένας ασφαλής αριθμός αιμοπεταλίων που να μειώνει τον κίνδυνο αιμορραγίας.
Όπως ανέφερε χαρακτηριστικά ο Alessandro Riva, MD, Global Head, Novartis Oncology Development and Medical Affairs: «Για τις οικογένειες και τους παρόχους φροντίδας των παιδιών που επηρεάζονται από μια σπάνια νόσο, το να έχουν μια νέα θεραπευτική επιλογή μπορεί να αλλάξει την προσέγγιση διαχείρισης της νόσου».
Η έγκριση της Eυρωπαϊκής Επιτροπής ισχύει για όλα τα 28 κράτη μέλη της ΕΕ, καθώς και για την Ισλανδία, τη Νορβηγία και το Λίχτενστάιν.
Η ITP είναι μια σπάνια αιματολογική διαταραχή που επηρεάζει σχεδόν πέντε ανά 100.000 παιδιά κάθε χρόνο και χαρακτηρίζεται από χαμηλό αριθμό αιμοπεταλίων και χαρακτηρίζεται από το γεγονός ότι το αίμα δεν πήζει όπως θα έπρεπε λόγω χαμηλού αριθμού αιμοπεταλίων.
Οι ασθενείς που πάσχουν από ITP συχνά έχουν μωβ μελανιές ή πολύ μικρές κόκκινες ή μωβ κηλίδες στο δέρμα. Συχνά μπορεί να πάσχουν από ρινορραγίες, αιμορραγίες στα ούλα κατά τις οδοντιατρικές εργασίες, ή άλλες αιμορραγίες που είναι δύσκολο να σταματήσουν. Στις περισσότερες περιπτώσεις, η ΙΤΡ θεωρείται ότι προκαλείται από μια αυτοάνοση αντίδραση, όπου το ανοσοποιητικό σύστημα ενός ανθρώπου επιτίθεται και καταστρέφει τα αιμοπετάλιά του.
Η ελτρομβοπάγη ανήκει σε μια κατηγορία φαρμάκων που ονομάζονται αγωνιστές υποδοχέων της θρομβοποιητίνης. Χρησιμοποιείται για να βοηθήσει στην αύξηση του αριθμού των αιμοπεταλίων στο αίμα. Τα αιμοπετάλια είναι αιμοσφαίρια που βοηθάνε στη μείωση ή την πρόληψη αιμορραγίας.
Ο στόχος της θεραπείας στη χρόνια ITP στα παιδιά είναι να διατηρηθεί ένας ασφαλής αριθμός αιμοπεταλίων που να μειώνει τον κίνδυνο αιμορραγίας.
Όπως ανέφερε χαρακτηριστικά ο Alessandro Riva, MD, Global Head, Novartis Oncology Development and Medical Affairs: «Για τις οικογένειες και τους παρόχους φροντίδας των παιδιών που επηρεάζονται από μια σπάνια νόσο, το να έχουν μια νέα θεραπευτική επιλογή μπορεί να αλλάξει την προσέγγιση διαχείρισης της νόσου».
Η έγκριση της Eυρωπαϊκής Επιτροπής ισχύει για όλα τα 28 κράτη μέλη της ΕΕ, καθώς και για την Ισλανδία, τη Νορβηγία και το Λίχτενστάιν.
Βιβλιογραφία
George JN, Woolf SH, Raskob GE. Idiopathic thrombocytopenic purpura: a practice guideline developed by explicit methods for the American Society of Hematology. Blood. 1996;88(1):3-40.
Immune Thrombocytopenia. US National Institutes of Health website. http://www.nhlbi.nih.gov/book/export/html/4917. Accessed February 1, 2016.
Fogarty PF, Segal JB. The epidemiology of immune thrombocytopenic purpura. Curr Opin Hematol. 2007;14(5):515-519.
Rodeghiero F, Stasi R, Gernsheimer T, et al. Standardization of terminology, definitions and outcome criteria in immune thrombocytopenic purpura of adults and children: report from an international working group. Blood. 2009;113(11):2386-2393.
Neunert C, Lim W, Crowther M, et al. The American Society of Hematology 2011 evidence-based practice guideline for immune thrombocytopenia. Blood. 2011;117(16):4190-4207.
Revolade Summary of Product Characteristics.
Bussel JB, Garcia de Miguel P, Despotovic JM, et al. Eltrombopag for the treatment of children with persistent and chronic immune thrombocytopenia (PETIT): a randomised, multicentre, placebo-controlled study. Lancet Haematol. 2015; published online July 29, 2015.
Grainger JD, Locatelli F, Chotsampancharoen T, et al. Eltrombopag for children with chronic immune thrombocytopenia (PETIT2): a randomised, multicentre, placebo-controlled trial. Lancet. 2015; published online July 29, 2015.
Immune Thrombocytopenia. US National Institutes of Health website. http://www.nhlbi.nih.gov/book/export/html/4917. Accessed February 1, 2016.
Fogarty PF, Segal JB. The epidemiology of immune thrombocytopenic purpura. Curr Opin Hematol. 2007;14(5):515-519.
Rodeghiero F, Stasi R, Gernsheimer T, et al. Standardization of terminology, definitions and outcome criteria in immune thrombocytopenic purpura of adults and children: report from an international working group. Blood. 2009;113(11):2386-2393.
Neunert C, Lim W, Crowther M, et al. The American Society of Hematology 2011 evidence-based practice guideline for immune thrombocytopenia. Blood. 2011;117(16):4190-4207.
Revolade Summary of Product Characteristics.
Bussel JB, Garcia de Miguel P, Despotovic JM, et al. Eltrombopag for the treatment of children with persistent and chronic immune thrombocytopenia (PETIT): a randomised, multicentre, placebo-controlled study. Lancet Haematol. 2015; published online July 29, 2015.
Grainger JD, Locatelli F, Chotsampancharoen T, et al. Eltrombopag for children with chronic immune thrombocytopenia (PETIT2): a randomised, multicentre, placebo-controlled trial. Lancet. 2015; published online July 29, 2015.






.jpg)

